写在前面
目前的主流研究认为,碱性环境中的氧还原反应(ORR)主要有两种反应途径。一种是四电子过程:
一种是二电子过程:
四电子过程可以保证在更短的时间内提供更大的电流,即四电子过程可以保证更大的电池(fuel cell/metal-air batteries)功率。氧还原反应的电化学性能测试常使用基于K-L方程的旋转圆盘电极(RDE)方法对反应转移电子数进行测算。
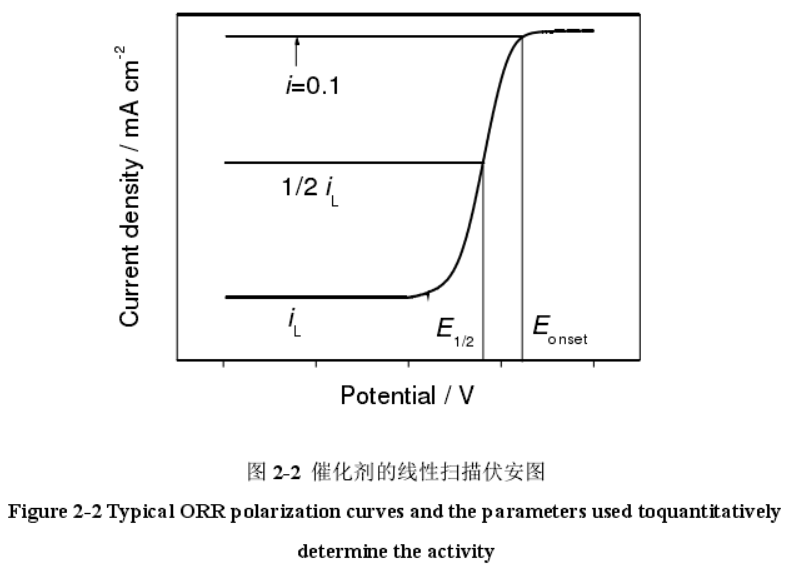
Ref: 周学俊. M-Nx/C类非贵金属氧还原催化材料的构筑及其电化学性能研究[D]. 东华大学, 2016.
K-L方程实际上建立了极限扩散电流$i_l$与旋转圆盘转速等物理因素之间的关系。通过不同转速下测试极限扩散电流,便可以拟合出关键的反应动力学参数——转移电子数。那么极限扩散电流到底是不是材料的本征性质呢?这个问题没有想象的那么简单,笔者首先介绍了K-L理论后我们再作判断不迟。
RDE下液流层的流体力学描述
如下图,建立RDE的柱坐标系。z = 0处为圆盘电极表面。
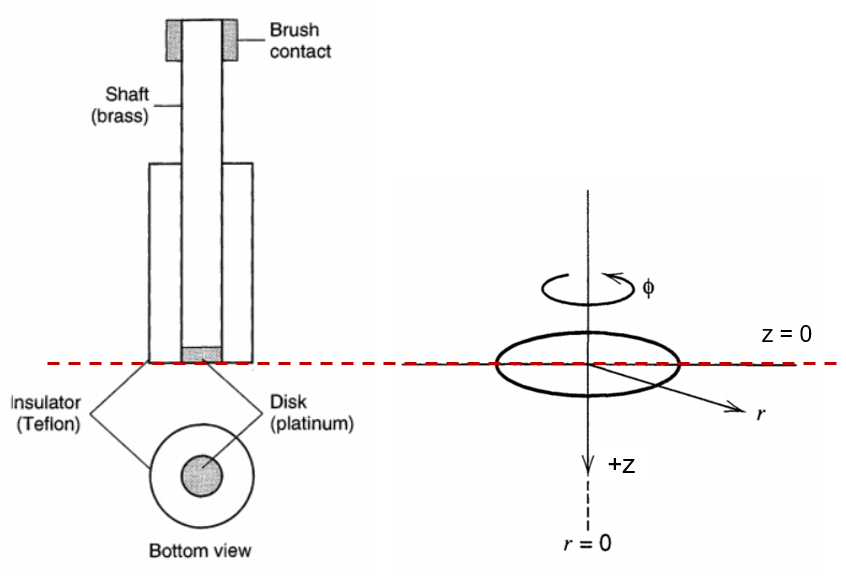
Ref: Bard et al., Electrochemical Methods: Fundamentals and Applications; wiley New York, 1980; Vol. 2.
定义液流速度
已知:
- 圆盘表面液体流速满足$v_r=0, v_phi=0, v_y=\omega r$.
- 本体溶液液体流速满足$v_r=0, v_phi=0, v_y=-U_0$.
由稳态下的纳维-斯托克斯方程(Navier–Stokes equations)可描述柱坐标下不同方向液体流速之间的关系
Ref: Real-Ramirez, C. A., & Gonzalez-Trejo, J. I. (2011). Hydrodynamic Analysis of Electrochemical Cells. In Computational Simulations and Applications. IntechOpen.
von Karman在1921年提出以独立无量纲变量来描述各方向速度值,可以满足N-S方程的限制条件,即
其中$\omega$为圆盘转速,$\mu$为液体粘度. 此时定义
可将N-S方程简化为
其边界条件为
Ref: von Kármán, T. (1921). Über laminare und turbulente reibung. Zeitschrift für Angewandte Mathematik und Mechanik, 1, 486.
Chochran在1934年提出使用无穷级数方法近似表示$F, G, H$三个函数。在离电极表面较近处,即$z$较小时,$\gamma << 1$,此时各方向速度值可表示为
其中,$a=0.51026$,$b=-0.6159$。
Ref: Cochran, W. G. (1934). The flow due to a rotating disc. Proceedings of the Cambridge Philosophical Society, 30, 365-375.
在圆盘表面$z \rightarrow 0$,即$\gamma \rightarrow 0$,可以获得速度值表达式
RDE法向的物质对流及扩散
柱坐标下的反应物的对流-扩散方程可以写为
由于反应物浓度相对于RDE轴对称,即反应物浓度在$\phi$方向无差别,所以有
在RDE表面径向上,在$0 \leq r \leq r_{disk}$,反应物浓度无差别,有
因此可将反应物物质对流-扩散方程简化为
$$ v_z (\frac{\partial C_o}{\partial z}) = D_o \frac{\partial^2 C_o}{\partial z^2} $$
将$v_z= -0.51 \omega^{2/3} v^{-1/2} z^2$代入上式得
其中,$B = \frac{D_o \omega^{-3/2} v^{-1/2}}{0.51}$. 接下来的任务就是对该偏微分方程进行积分处理,尝试求解。可以先令$X = \frac{\partial C_o}{\partial z}$,有
两边积分可解得
再将$X = \frac{\partial C_o}{\partial z}$带回,有
这时候即将对该式进行二次积分。但是该次积分积分限的选取具有不同的物理意义。一种情形是电极表面的反应动力学很快,反应物一到电极表面就转化为产物,电极表面反应物浓度为零的情形。这种情况下,电流仅受到物质扩散传质的限制,我们称之为“极限电流情形”。另一种情形是电极表面的反应动力学没有那么快,电极表面反应物浓度不为零的情形,我们称之为“非极限电流情形”。接下来我们就来讨论分别描述这两种情形的Levich方程和Koutecky-Levich方程。
极限电流情形
在极限电流情形下,电极表面反应物浓度为零,则
有定积分
其中$\Gamma$函数为
其在[0,3]区间的函数图像如下
故
又因为电流与电极表面的物质流量相关,由法拉第定律可得
与上式联立可得Levich方程
$$ i_l = 0.62 nFAD^{2/3} \omega^{1/2} \mu^{-1/6} C_o^* $$
从上式我们已经可以知道,对特定电极反应(转移电子数n不变),极限扩散电流是旋转圆盘转速的函数——因为法拉第常数$F$、电极面积$A$、圆盘尺寸、电解液中反应物扩散系数$D$、电解液粘度$\mu$和电解液浓度$C_o^*$都是恒定的。对不同材料,氧还原所经历路径不同,也就可能导致电极表面的电极反应不同,会反应在转移电子数上,从而导致极限扩散电流的不同。因此,本文的结论就是,在正确的表征方法下,极限扩散电流是材料的本征性质(活性位点催化选择反应路径的性质)。
非极限电流情形
在非极限电流情形下,电极表面反应物浓度不为零,则
且$C_o(z=0) \neq 0$. 同极限电流情形进行积分可得
由Levich方程可得
对单步骤完全不可逆反应过程有
其中反应速率常数$k_f(E) = k_0 \exp[-\alpha f(E-E^\Theta)]$可由反应动力学B-V方程导出。那么该式与上式联立可得
可以定义
那么便有Koutecky-Levich方程
$$ \frac{1}{i} = \frac{1}{i_k} + \frac{1}{i_l} = \frac{1}{i_k} + \frac{1}{0.62 nFAD^{2/3} \omega^{1/2} \mu^{-1/6} C_o^*} $$
从上式我们可以看出,Levich方程所描述的极限电流情形是Koutecky-Levich方程中$i_k \rightarrow \infty$时的情形。K-L方程的物理意义是:在无表面修饰的电极上,总电流主要由反应动力学导致的电流$i_k$和传质所导致的电流$i_l$构成。
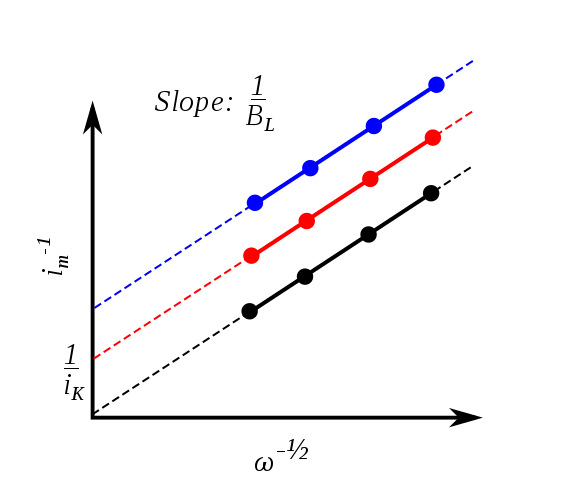
如果电极的表面物理化学性质发生变化(也即电极经过表面修饰),那么反应的转移电子数必定会发生变化,从而反映在K-L拟合直线的斜率上。当然,这个变化也会反映在拟合直线的截距$\frac{1}{i_k}$上,但其中含有$k_f(E)$这一不易确定的反应动力学参数,所以其不容易被定量分析。
理论上可以通过取不同电压的电流和转速作图,便能够获得不同电压的转移电子数。要更明确地得到不同电位下的转移电子数,需要采用旋转环盘电极(RRDE)方法。旋转环盘电极方法在笔者之前的博文中有介绍其原理(氧还原反应(Oxygen Reduction Reaction)基础)。
写在后面
总结本文得到的结论:
- 如果电极的表面物理化学性质发生变化(也即电极经过表面修饰),那么反应的转移电子数必定会发生变化,从而反映在K-L方程拟合直线的斜率和截距上。
- 在正确的表征方法下,极限扩散电流是材料的本征性质(活性位点催化选择反应路径的性质)。
- 负载量可能会通过活性位点暴露的角度对极限扩散电流产生影响。但在一定范围内,其影响可能是不大的。
在ORR测试中,需要通过K-L方程计算不同偏压下的转移电子数。这时候一定要注意各数值的量纲问题!在转速使用“rpm”(Revolutions Per Minute,圈/分)时,常数取“0.2”,[5] 即使用公式:$i_l = 0.2 nFAD_o^{2/3} \omega^{1/2} \mu^{-1/6} C_o^*$;在转速使用“rad/s”(Radian Per Second,弧度/秒)时,常数取“0.62”,[6] 即使用公式:$i_l = 0.62 nFAD_o^{2/3} \omega^{1/2} \mu^{-1/6} C_o^*$(如果纵坐标已经取电流密度,记得将等式右边的A略掉)。
ORR计算常用物理常数:法拉第常数$F=96485 C mol^{-1}$,氧气在电解液中的饱和浓度$C_o = 1.2 \times 10^{-3} mol L^{-1}$,氧气在KOH溶液中的扩散系数$D_o = 1.9 \times 10^{-5} cm s^{-1}$,电解液粘度$\mu = 0.01 cm^2 s^{-1}$.
总之,极限扩散电流影响因素较多,非预期的实验结果一定要仔细分析!
参考文献
[1] Bard, A. J., Faulkner, L. R., Leddy, J., & Zoski, C. G. (1980). Electrochemical methods: fundamentals and applications (Vol. 2). New York: wiley.
[2] Real-Ramirez, C. A., & Gonzalez-Trejo, J. I. (2011). Hydrodynamic Analysis of Electrochemical Cells. In Computational Simulations and Applications. IntechOpen.
[3] von Kármán, T. (1921). Über laminare und turbulente reibung. Zeitschrift für Angewandte Mathematik und Mechanik, 1, 486.
[4] Cochran, W. G. (1934). The flow due to a rotating disc. Proceedings of the Cambridge Philosophical Society, 30, 365-375.
[5] Han S, Hu X, Wang J, et al. Novel Route to Fe‐Based Cathode as an Efficient Bifunctional Catalysts for Rechargeable Zn–Air Battery[J]. Advanced Energy Materials, 2018, 8(22): 1800955.
[6] Liang Y, Li Y, Wang H, et al. Co 3 O 4 nanocrystals on graphene as a synergistic catalyst for oxygen reduction reaction[J]. Nature materials, 2011, 10(10): 780-786.